

【好药记】一致性评价受理号突破600,299个为289品种;本周科伦20亿大品种,复星首家...
截止12月13日,CDE受理一致性评价申请受理号达616个(按补充申请计算,下同),涉及235家企业的217个品种药品;其中289目录药品受理号有299个(82个品种);已有98个受理号46个品〓种通过一致性评价,289品种仅22个通过一致性¤评价。本周(12月6日至12月13日)又有2个289目录药品过评,3个药品审批完毕,通过在即,还有36受理号23品种获承办,更多详情且随小编一起看看。
一致性评价办理状态更新
本周,重庆药友289目录药品氯化钾♀颗粒抢在大限之期前首家通过一致性评价,四川科伦的289品种阿莫西林胶囊(0.25g(按C16H19N3O5S计))通过一致性评价,成为该品种该规格第4家过评企业;此外,还有3品种“审批完毕-待制证”,通过在即,恒瑞两款重磅注射剂在内,为多西他赛注射液和盐酸⌒伊立替康注射液,详情可见下表。
本周一致性评价审评审批办理详情

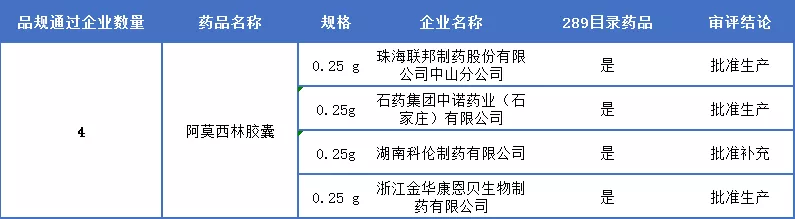
阿莫西林胶囊
12月13日,湖南科伦药业申报的阿莫西林胶囊通过一致性评价,阿莫西林胶囊为289目录品种,是医保甲←类及2018版基药目录药品,2017年阿莫西林胶囊中国销售额约20.59亿元。据药智数据,其一致性评价申报非常火热,有19家企业申报,受理号达26个,目前加上科伦,通过企业达4家。
阿莫西林胶囊胶囊一致性评价通过详情
氯化钾颗粒
12月5日,复星医药其子公司重庆药友的289目录药品氯化钾颗粒首家通过一致性评价。据复星医药公告显示,2017年度,重庆药友该药品于中国境内(不包括港澳2台地区)销售额约为人民币71万元(未经审计)。截止10月,复星集团针对该药品一致性评价已投入研发费用人民币约154万元(未经审计)。
氯化钾颗粒主要治疗低钾血症、预防低钾血症,并适用于洋地黄中毒引起频发性、多源性早搏或快速心律失□常。
据药智国产药品数据库,国产氯化钾颗粒生产单位仅3家,为武汉太福制药、重庆药友、杏辉天力(杭州)药业,目前仅重庆药友首家申报且首家过评。另外国内︽氯化钾制剂除了颗粒剂型还有90家企业持有氯化钾注射液生产批文,10家企业持有氯化钾缓释片生产批文,13家企业持有氯化钾片生产批文。
多西他赛注射液
12月10日,据药智药品注册与受↓理数据库显示,江苏恒瑞医药的多西他赛注射液其中1个受理号一致性评▃价“审批完毕-待制证”。
多西他赛是紫杉烷的半合成产物,是一种作用于细胞微管的抗癌药物,主要用于治疗先期化疗失败的晚期或转移性乳腺癌、以顺铂为主的化疗失败的晚期或转移性非小细胞肺癌。由法国Sanofi-Aventis开发,最早于1995年11月在欧盟上市。1996年5月FDA批准上市,2002年恒瑞医药该药品获批在国内上市,据悉,恒瑞医药是第九家获批上市的仿制药公司。
据药智国产药品数据库显示,目前国产多西他赛注射液生产批文有39条,生产企业20家,另据药智药品注册与受理数据库统计,截止目※前申报一致性评价的有仅正大天晴和江苏恒瑞,值得注意的是正大天晴的该品种审评状态已于9月更新为“已发件”,却一直没有消息通告已过评,此次恒瑞也审评审批完毕,会否过评,值得关注的。
多西他赛注射液◆一致性评价详情表

盐酸伊立〗替康注射液
12月10日,据药智药品注册与受理☆数据库显示,江苏恒瑞医药的盐酸伊立替康注射液又一受理号一致性评价“审批完毕-待制证”。
盐酸伊立替康注射液是抗消化道肿瘤的化疗用药。原研公司◤为澳大利亚Pfizer(Perth)PtyLimited。据悉,目前国内盐酸伊立替康注射液市场主要由恒瑞,辉瑞及齐鲁制药占据,其中恒瑞占比超60%。
据药智国产药品数据库显示,我国现有盐酸□伊立替康注射液国产批文9条,生产单位5家。目前申报一致性评价的企业仅齐鲁▃和恒瑞制∞药,此前齐鲁制药其中的2个受理号已发批件,恒瑞的一个受理号显示已发批件,如今又一受理号也已审批完毕,两家企业谁将拔得头筹,坐等官宣。
盐酸伊立替康♀注射液一致性评价详情表
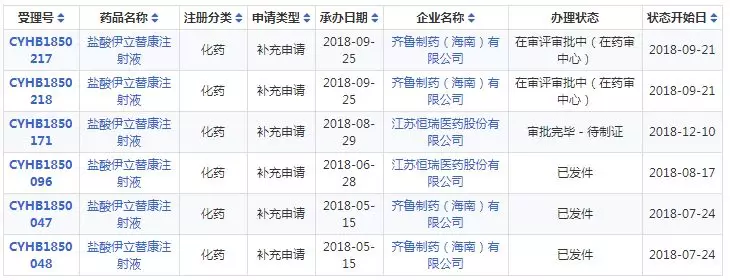
草酸艾司西酞普兰片◣
12月10日,据药智药品注册与受理数据库显示,浙江金华康恩贝生物制药草酸艾司西酞普兰片“审批完毕-待制证”。
据药智药品注册与受理数据库显示,截止目前,草酸艾司∏西酞普兰片一致性评价申报企业4家,其中四川科伦药业、湖南洞庭药Ψ业和山东京卫制药3家企业已经相继过评,此次,若浙江金华康恩贝生物制药该药品顺利通过将成为第4家过评企业。
草酸艾司西酞普兰片一「致性评价详情表
一致性评价承办状态更新
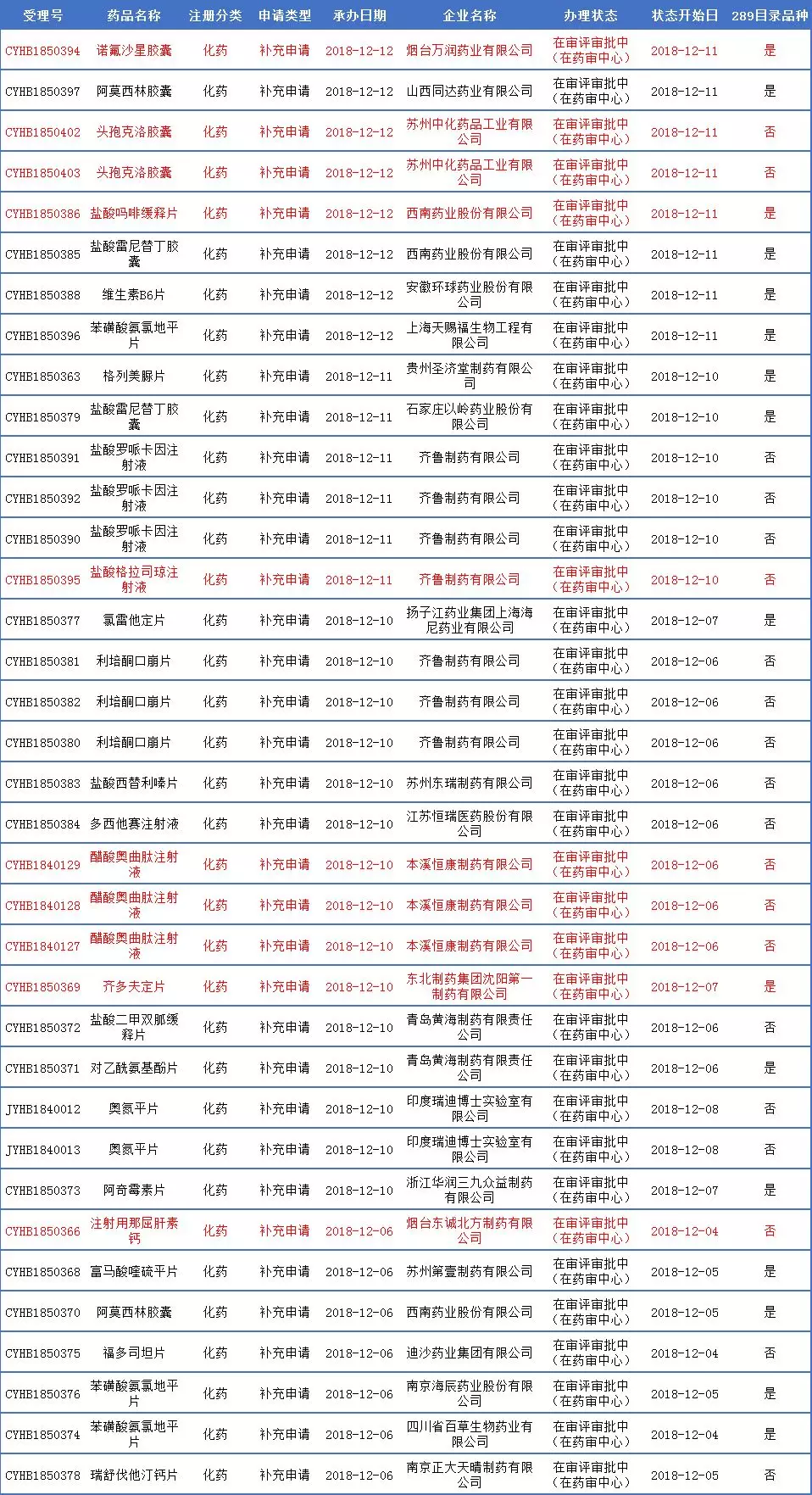
本周CDE新增一致性评价受理号36个,涉及23个品种,其中289目录药品16个受理号(12品种);还有5个注射剂申报一致性评价获受理,其中3个为首家申报,为齐鲁制药盐酸格拉司琼注射液、本溪恒康制药的醋酸奥曲肽注☆射液和烟台东诚北方制药的注射用那屈肝素钙;另外,东北制药集团沈阳第一制药齐多●夫定片,烟台万润药业的诺氟沙星胶囊,苏州中化ω药品工业的头孢克洛胶囊,西南药业的盐酸吗啡缓释片也为首家申报获受理品种,因此↑本周共有7个首家申报药∞品。以下看看其中几个药品情况:
本周一致性评价申♂报获受理详情表
盐酸格拉司琼注射液
12月10日,齐鲁制药盐酸格拉司琼注射液一致性评价获CDE承办。
盐酸格拉司琼注射液第一代5-HT3受体拮抗剂,用于放射治疗、细胞毒类▂药物化疗引起的恶心和呕吐。由罗氏原卐研,据药智数据〖显示,现有国产盐酸格拉司琼注射液国产批文40条,生产企业34家,申报一致性评价目前仅齐鲁制药,亦没有其他企业参比备案。
醋酸奥曲肽注射液
12月10日,本溪恒康制药醋酸奥曲肽注射液一致性评价获CDE承办。
醋酸奥曲肽注射液是人工合成的八肽化合物,为十四肽人生长抑素〓类似物,国家乙类医保目录药品,临床主要用于治疗胰腺炎、食管-胃静脉曲张出血、防治胃肠←胰瘘等症状。奥曲肽是▅由化学家WilfriedBauer于1979年首次合成。原研单位为诺华制药,作用靶点是GHRF,SSTR。1988年获批上市,商品名为善宁。
据药智数据显示,我国现有醋酸奥曲肽注射液国产批文28条,生产企业16家,申报该药品一致性评价的企业仅本溪恒康制药,国药一心制药和上海诺华贸易有进行参比备案。
注射用那屈肝素钙
12月6日,烟台东诚北方制药的注射用那屈肝素钙一致性评价获CDE承办。
那屈肝素钙是一种新型的抗血栓形成药物,通过解聚从猪肠黏膜中提取的肝素而得,属于低分子肝素制剂。原研企业为葛兰素史〓克的速碧林。据悉那屈肝素是全球销量最大的3种低分子肝素制剂之一,全球销售额超过3亿美元。国内那曲肝素钙制剂(含低分子肝素钙)市场模约20亿元,速碧林占据近半市场份额。
据药智国产数据库显示,注射用那屈肝素钙目前仅烟台东诚北方制药拥有国产批文,是国内拥有㊣ 的唯一那屈肝素钙粉针剂型,且由于国家已经停止该剂型那屈肝素钙的审批,所以烟台东诚北方制药将是永久独家。此次申报一致性评价若顺利过评,将更加巩固其市场地位,并向原研发起冲击。
齐多夫定片
12月10日,东北制药集团沈阳第一制药289目录药品齐多夫定片一致性评价申报获CDE承办。
齐多夫定为抗病毒药,用于艾滋病或与艾滋病有关的综合症患者及免疫缺陷病毒(HIV)感染的治疗。由葛兰素史克原研,1987年获FDA批准上市,其是世界上第一个获得美国FDA批准生产的抗艾滋病药品,因其疗效确切,成为“鸡尾酒”疗法最基本的组合成分。
据药智国产数据库显示,我国现有齐多夫定片国产批文8条,生产企业6家,另据药智药品一致性ζ评价进度数据库,上海迪赛诺生物医药已参比备案一致性评价,东北制药集团沈阳第一制药首家申报获受理,值得一提的是该品种可豁免BE试验,有望加速过评。
声明:本文观点仅代表作者本人,不代表药智网立场,欢迎在〗留言区交流补充;如需转载,请务必注明文章作者和来源。
文来自:药智汇